政策法規 || 關于擴大藥品電子通用技術文檔實施范圍的公告(2025年第10號)(附法規概覽1.13-1.24)
01
國家藥監局關于擴大藥品電子通用技術文檔實施范圍的公告(2025年第10號)
為加快推進藥品電子通用技術文檔(以下簡稱eCTD)在我國的實施進程,提升“互聯網+藥品監管”應用服務水平,現將擴大eCTD實施范圍有關事項公告如下:一、在《國家藥監局關于實施藥品電子通用技術文檔申報的公告》(2021年第119號)中eCTD實施范圍基礎上,進一步擴大實施范圍,自2025年1月27日起,化學藥品1類至5類的藥物臨床試驗申請,化學藥品2類、3類、4類、5.2類的上市許可申請,以及預防用生物制品和治療用生物制品1類至3類的藥物臨床試驗申請、2類和3類的上市許可申請,可按照eCTD進行申報。二、采用eCTD進行申報的,申請人按照現行的eCTD技術文件要求準備和提交eCTD電子申報資料。鼓勵采用網絡傳輸方式提交eCTD電子申報資料,具體操作請參考國家藥品監督管理局藥品審評中心網站《關于試行以網絡傳輸方式提交藥品注冊電子申報資料的通知》。

掃描圖中二維碼
查看詳細信息

02
國家藥監局綜合司關于印發2025年藥品檢驗能力驗證計劃的通知
根據《國務院辦公廳關于全面加強藥品監管能力建設的實施意見》(國辦發〔2021〕16號)和《國家藥監局綜合司關于加強和改進藥品檢驗檢測能力驗證工作的通知》(藥監綜科外〔2020〕67號)要求,為提升藥品、醫療器械、化妝品檢驗機構能力和水平,國家藥監局組織制定了2025年藥品檢驗能力驗證計劃,該計劃由中國食品藥品檢定研究院負責組織實施。
掃描圖中二維碼
查看詳細信息

03
國家藥監局藥審中心關于發布《放射性治療藥物申報上市臨床風險管理計劃技術指導原則》的通告(2025年第5號)
為進一步明確放射性治療藥物上市后如何進行臨床風險管理,本指導原則將針對上市后臨床風險管理計劃、說明書中安全性相關內容、患者指導手冊的撰寫提供具體指導意見。

掃描圖中二維碼
查看詳細信息

04
國家藥監局核查中心關于發布《清潔驗證技術指南》的通告
經國家藥品監督管理局仿制藥質量和療效一致性評價專家委員會審核確定,現發布仿制藥參比制劑目錄(第八十九批)。為指導和規范藥品上市許可持有人、藥品生產企業(含原料藥登記人)等對藥品生產設備及部件清潔驗證的科學管理,有效降低藥品生產過程中污染與交叉污染風險,核查中心組織制定了《清潔驗證技術指南》。
掃描圖中二維碼
查看詳細信息

05
國家藥監局核查中心關于發布《細胞治療產品生產檢查指南》的通告
為指導檢查員開展細胞治療產品生產環節檢查工作,進一步加強細胞治療產品生產質量管理,國家藥監局核查中心組織制定了《細胞治療產品生產檢查指南》。
掃描圖中二維碼
查看詳細信息

01
國家藥監局關于中藥保護品種的公告(延長保護期第20號)(2025年第9號)
掃描圖中二維碼
查看詳細信息

02
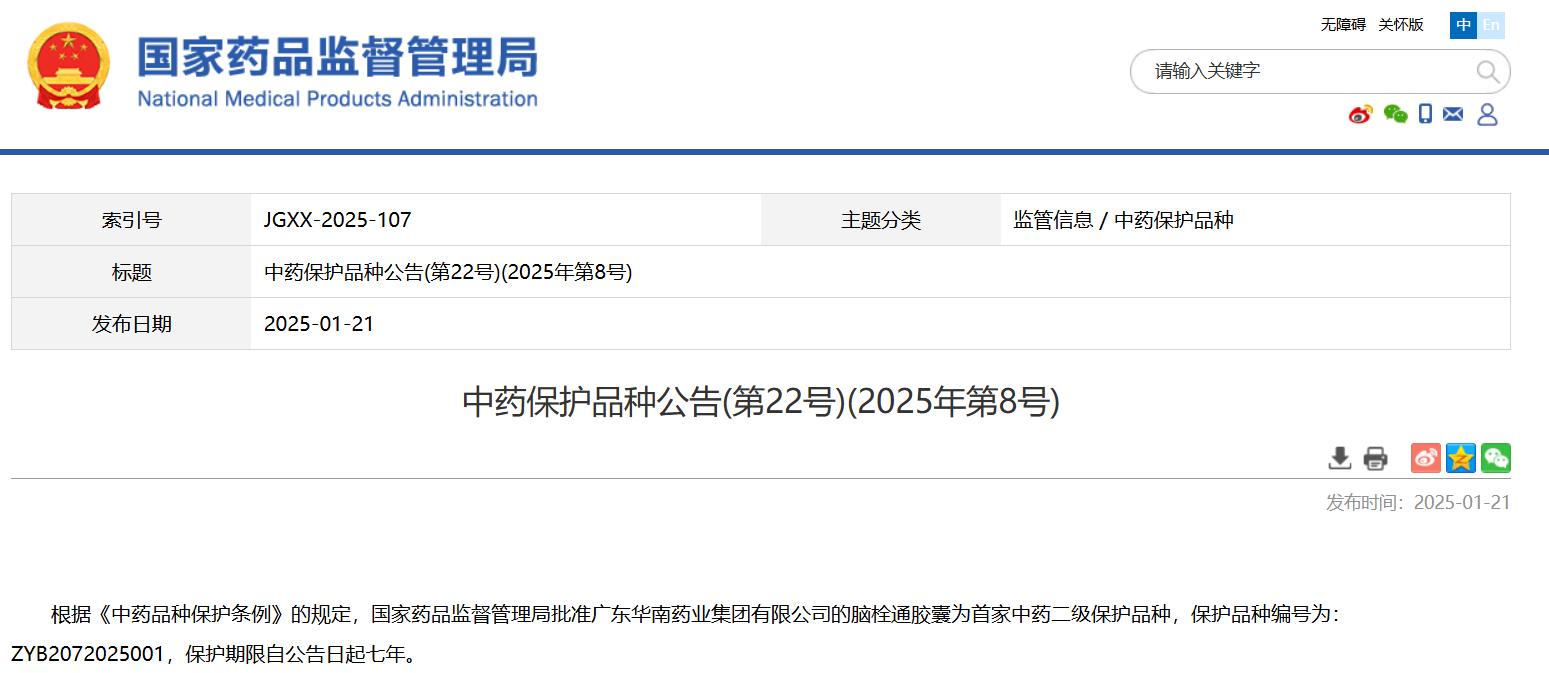
中藥保護品種公告(第22號)(2025年第8號)
掃描圖中二維碼
查看詳細信息

03
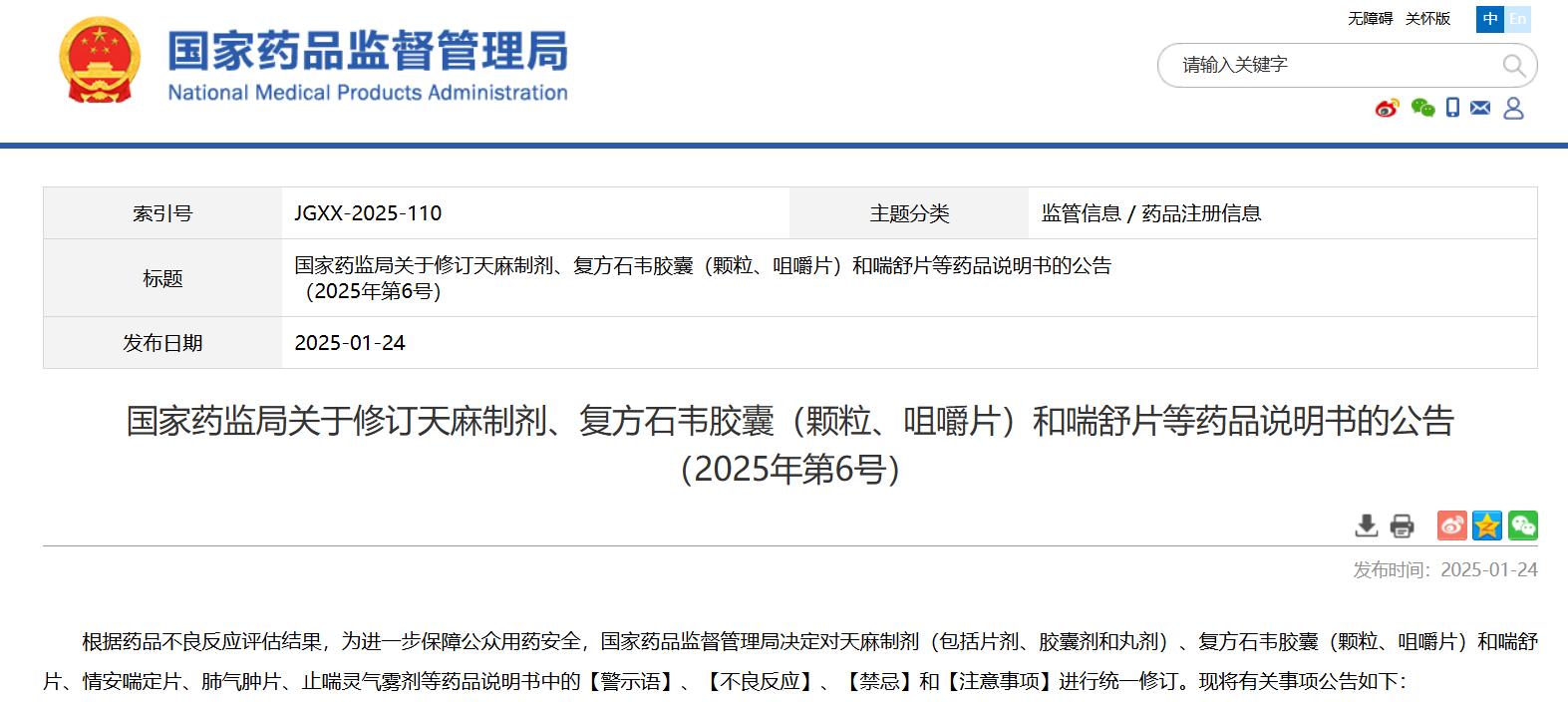
國家藥監局關于修訂天麻制劑、復方石韋膠囊(顆粒、咀嚼片)和喘舒片等藥品說明書的公告(2025年第6號)
掃描圖中二維碼
查看詳細信息

01
國家藥監局藥審中心關于發布《預防用mRNA疫苗非臨床研究技術指導原則》的通告(2025年第7號)

掃描圖中二維碼
查看詳細信息

02
國家藥監局藥審中心關于發布《疫苗說明書臨床相關信息撰寫指導原則(試行)》的通告(2025年第9號)

掃描圖中二維碼
查看詳細信息

03
國家藥監局藥審中心關于發布《預防用猴痘疫苗藥學研究技術指導原則(試行)》的通告(2025年第8號)

掃描圖中二維碼
查看詳細信息

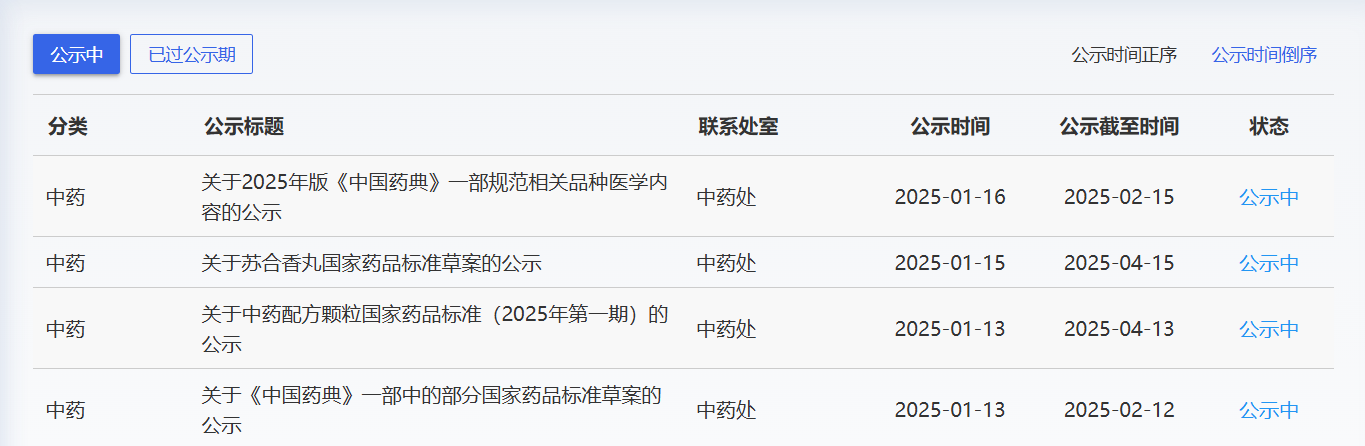
近期,藥典委發布的標準草案公示如下:
-END-


轉載聲明:未經本網或本網權利人授權,不得轉載、摘編或利用其他方式使用上述作品。已經本網或本網權利人授權使用作品的,應在授權范圍內使用,并注明“來源:新領先醫藥科技”。

 Hotline服務熱線:010-61006450
Hotline服務熱線:010-61006450
 簡體中文
簡體中文

 010-61006450
010-61006450 聯系地址:
聯系地址: 技術市場部:
技術市場部: 北京新領先
北京新領先 新領先藥訊
新領先藥訊 010-61006450
010-61006450
