摘要 | 藥品注冊檢驗及注冊現場核查法規(附流程圖)
藥品注冊檢驗
藥品審評中心(CDE)組織制定公布:藥品注冊檢驗啟動的原則、程序、時限等要求
中檢院制定公布:藥品注冊申請受理前提出藥品注冊檢驗的具體工作程序和要求以及藥品注冊檢驗技術要求和規范
-
標準復核,是指對申請人申報藥品標準中設定項目的科學性、檢驗方法的可行性、質控指標的合理性等進行的實驗室評估。-與國家藥品標準收載的同品種藥品使用的檢驗項目和檢驗方法一致的,可以不進行標準復核,只進行樣品檢驗。
-
樣品檢驗,是指按照申請人申報或者藥品審評中心核定的藥品質量標準對樣品進行的實驗室檢驗。
-
前置注冊檢驗:藥品上市許可申請受理前,申請人提出的藥品注冊檢驗。
-
上市申請審評中注冊檢驗:藥品審評中心基于風險啟動的質量標準部分項目復核和現場核查的抽樣檢驗,以及因申報資料真實性存疑或投訴舉報等基于審評需要啟動的有因抽樣檢驗。
-
上市申請受理時注冊檢驗:在上市許可申請受理后40個工作日內由藥品審評中心啟動的藥品注冊檢驗。
-
上市批準后補充申請注冊檢驗:上市批準后補充申請審評過程中,藥品審評中心于申請受理后40個工作日內基于風險啟動的注冊檢驗。
-
中檢院:中檢院承擔境內外生產的創新藥、改良型新藥(中藥除外)、生物制品、按照藥品管理的體外診斷試劑的注冊檢驗工作;負責組織口岸藥品檢驗機構開展需由其承擔的境外生產藥品的注冊檢驗。
-
省所:省級藥品檢驗機構,承擔轄區內除中檢院和口岸藥品檢驗機構職責外的藥品注冊檢驗工作。
-
指定機構:中檢院或國家藥品監督管理局指定的藥品檢驗機構承擔放射性藥品和國家藥品監督管理局規定的其他藥品的注冊檢驗工作。
-
口岸:口岸藥品檢驗機構,按要求參加中檢院組織的境外生產藥品的注冊檢驗工作。
01準備申請(省所要求不同)
-
啟動-受理后40日內
-
藥品審評中心啟動的注冊檢驗,申請人應當在30個工作日內,向省級藥品監督管理部門申請完成抽樣并向藥品檢驗機構送樣。現場核查抽樣檢驗應在抽樣后10個工作日內向藥品檢驗機構送樣
-
資料和樣品接收審核5個工作日。樣品檢驗60個工作日,樣品檢驗和標準復核90個工作日。藥品注冊檢驗過程中補充資料時限30個工作日
-
需要藥品檢驗機構提交注冊檢驗報告的,藥品審評中心應當在審評時限屆滿40個工作日前告知。藥品檢驗機構按要求應當配合藥品審評中心,通過“數據共享平臺”推送注冊檢驗報告。
注冊現場核查法規
藥品注冊申請受理后,藥品審評中心(CDE)在藥品注冊申請受理四十日內通知藥品核查中心(CFDI)啟動注冊核查工作,以核實申報資料的真實性、一致性以及藥品上市商業化生產條件,檢查藥品研制的合規性、數據可靠性等。
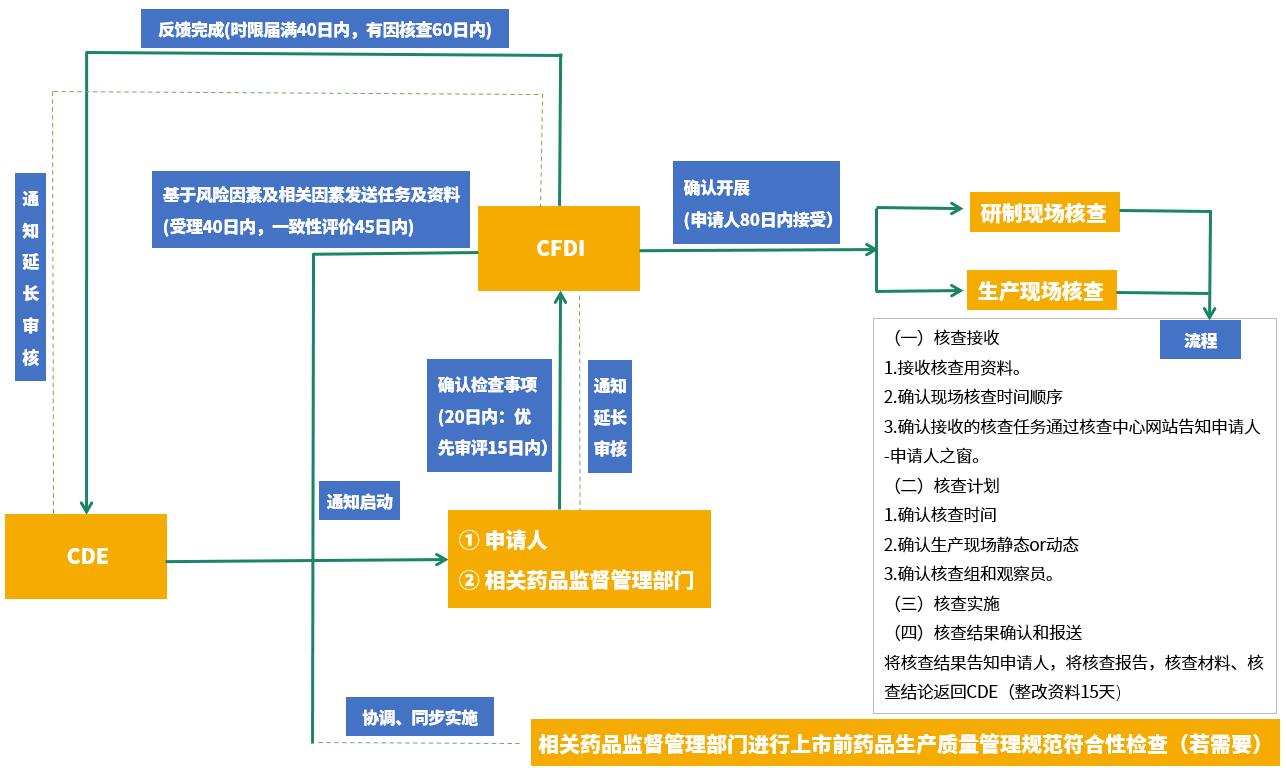
備注:
-
核查過程中認為有必要進行樣品檢驗的,所抽取的樣品應在核查結束之日起10日內,送達指定藥品檢驗機構。
-
延長時限不超過原時限的二分之一。
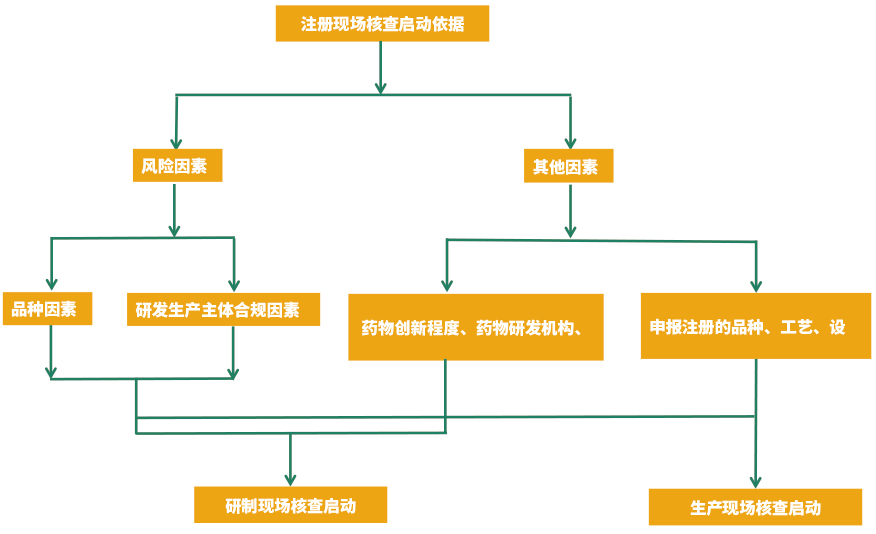


備注:
-
原則上以品種因素和研發生產主體合規因素中風險情形較高的確定注冊申請風險等級,特殊情況的除外。對于補充申請,生物制品和中藥注射劑不納入品種因素高風險情形。
-
藥品研制基本情況(如屬委托,應說明被委托研究單位基本情況)。
-
研制所涉及的批次(含BE批)批量用途,研制批次(含BE批)生產的地址、生產線、時間地點、使用量和剩余量等。
-
研制批次(含BE批)所用處方生產工藝、原輔料包裝材料來源及標準、生產線(設備設施)、產品質量標準(含中間控制標準)等是否與已上市/擬上市商業化生產規模的批次一致。
-
參比制劑的來源、采購和使用情況。
-
藥品和參比制劑體外研究的對比研究情況,研究時間、批號和研究結果。(質量對比和溶出曲線)
-
藥品關鍵質量屬性(含穩定性)研究情況。(全檢數據及穩定性數據)
-
接受現場檢查品種全套注冊申報資料。
-
委托研究協議和質量協議,如有。
-
參比制劑的來源及證明,如購買發票、贈送證明等。參比制劑的包裝標簽、說明書、剩余樣品等。參比制劑的接收、發放、使用記錄或憑證。
-
藥品相關研究記錄,包括:處方工藝研究原始記錄,如有;樣品試制相關原始記錄;質量研究相關原始記錄;體外評價及穩定性研究的相關原始記錄;儀器設備使用記錄;紙質圖譜及電子圖譜。
-
其他相關文件,包括:處藥品檢驗方法確認或驗證資料;穩定性試驗方案及報告;體外研究總結報告;溶出度儀的驗證資料;研究用的剩余樣品情況(不應銷毀)。
-
組織機構與人員:研究內容相適應的管理機構,相應的質量管理;具有資質的人員
-
研究條件:場地、設備、儀器和管理制度
-
文件和記錄:應當建立文件和記錄管理的制度或標準操作規程。藥物研究開發全過程應有相應記錄,包括預試驗和探索性研究的數據和記錄
-
變更和偏差管理:至少在藥物進入臨床階段后就應當建立與藥物研發階段相適應的變更、偏差和失敗管理制度或標準操作規程,針對關鍵批次出現的偏差或失敗應當得到適當的調查和/或分析,并進行記錄
-
委托機構:
? 委托其他機構進行全部或部分藥學研究及樣品試制的,委托方應當對受托方的研究能力、質量管理體系等進行評估,以確證其研究條件和研究情況
? 雙方應當簽訂委托合同或其他有效證明
? 委托方應當對委托研究的過程和結果負責,并確保委托研究過程中的數據可靠性。受托方應當遵守相關要求,保證研究及樣品制備過程規范、數據真實可靠、研制過程可追溯
-
發現真實性問題或申報資料真實性存疑,申請人不能證明其真實性的;
-
關鍵研究活動、數據缺少原始記錄導致無法溯源的;
-
發現與申報資料不一致,可能影響質量評價的;
-
存在嚴重的數據可靠性問題,導致對藥品安全性、有效性、質量可控性的評價產生影響的;
-
拒絕、不配合核查,導致無法繼續進行現場核查的。
參考文獻:
1.《藥品注冊管理辦法》(2020年27號)-第四、五節
2.《藥品注冊檢驗工作程序和技術要求規范(試行)》(2020年7月)
3.《藥品質量抽查檢驗管理辦法》(國藥監藥管〔2019〕34號)及藥品抽樣原則及程序(征求意見稿)
4.《藥品注冊核查檢驗啟動原則和程序管理規定(試行)》(征求意見稿)及起草說明 (2020年4月)
5.《藥品注冊核查實施原則和程序管理規定(征求意見稿)》及起草說明(2020年5月)
6.《藥品注冊核查要點與判定原則(征求意見稿)》及起草說明(臨床、非臨床、研制和生產現場) (2020年5月)
7.《仿制藥質量和療效一致性評價現場核查指導原則》(臨床試驗數據、研制現場核查、生產現場核查、有因核查)( 2017年第77號)
8.企業指南(草案):《仿制藥質量和療效一致性評價現場檢查要求》(研制現場、生產現場)(2018年4月)
9.《藥品注冊現場核查管理規定》(國食藥監注[2008]255號)
10.《藥品檢查管理辦法(試行)》(國藥監藥管〔2021〕31號)
11.《藥品生產現場檢查風險評定指導原則》(食藥監藥化監〔2014〕53號)
-END-
關于我們:
北京新領先成立于 2005 年,注冊資金近億元,于 2015 年實現上交所上市(股票代碼:600222),是一家面向全球提供藥學臨床前研究、臨床 CRO 和CDMO服務的高新技術企業,連續多年蟬聯“中國醫藥研發公司榜首”。
目前,公司已與國內外上下游500余家企業建立合作關系,其中部分企業為戰略合作關系。累計承接了藥學研發項目400余項、臨床研究項目500余項,申請專利200余項,獲得授權近百項。
公司從建立伊始就以“是我,讓中國新藥技術和生產工藝與世界同步”作為企業愿景,致力于用創新的研發和服務模式以及信息化技術推動中國醫藥產業發展,縮小與世界先進水平間的差距,讓中國人民早日用上安全藥和良心藥!
公司總部位于北京中關村高新技術園區,擁有 10000 平米研發實驗室,同時在鄭州臨空生物園區建立了新藥篩選及檢測平臺、藥物評價平臺(動物房,GLP、AAALAC、CNAS 認證)、大分子中試及大規模生產服務平臺、小分子 CMC 制劑研究生產平臺、細胞技術服務平臺和臨床 CRO 平臺等六大符合國際標準(FDA、EMA 和 NMPA GMP 標準)的研發平臺,形成“新領先 CXO”全產業鏈服務體系。仿創結合,雙引擎驅動,能夠為客戶提供藥學研發全生命周期的多元化服務。


轉載聲明:未經本網或本網權利人授權,不得轉載、摘編或利用其他方式使用上述作品。已經本網或本網權利人授權使用作品的,應在授權范圍內使用,并注明“來源:新領先醫藥科技”。

 Hotline服務熱線:010-61006450
Hotline服務熱線:010-61006450
 簡體中文
簡體中文

 010-61006450
010-61006450 聯系地址:
聯系地址: 技術市場部:
技術市場部: 北京新領先
北京新領先 新領先藥訊
新領先藥訊 010-61006450
010-61006450
