一文教你讀懂FDA審評報告!
美國FDA藥品數據庫包含1939年起的絕大多數批準藥品,1998年之后批準的藥品全部信息。Drugs@FDA作為FDA網站中一個數據庫主要可以幫助我們完成相關信息的查找。
審評報告詳細查詢流程:(以阿昔替尼片為例)
- 首先進入Drugs@FDA的搜索欄輸入阿昔替尼片的活性成分“axitinib”,然后點擊提
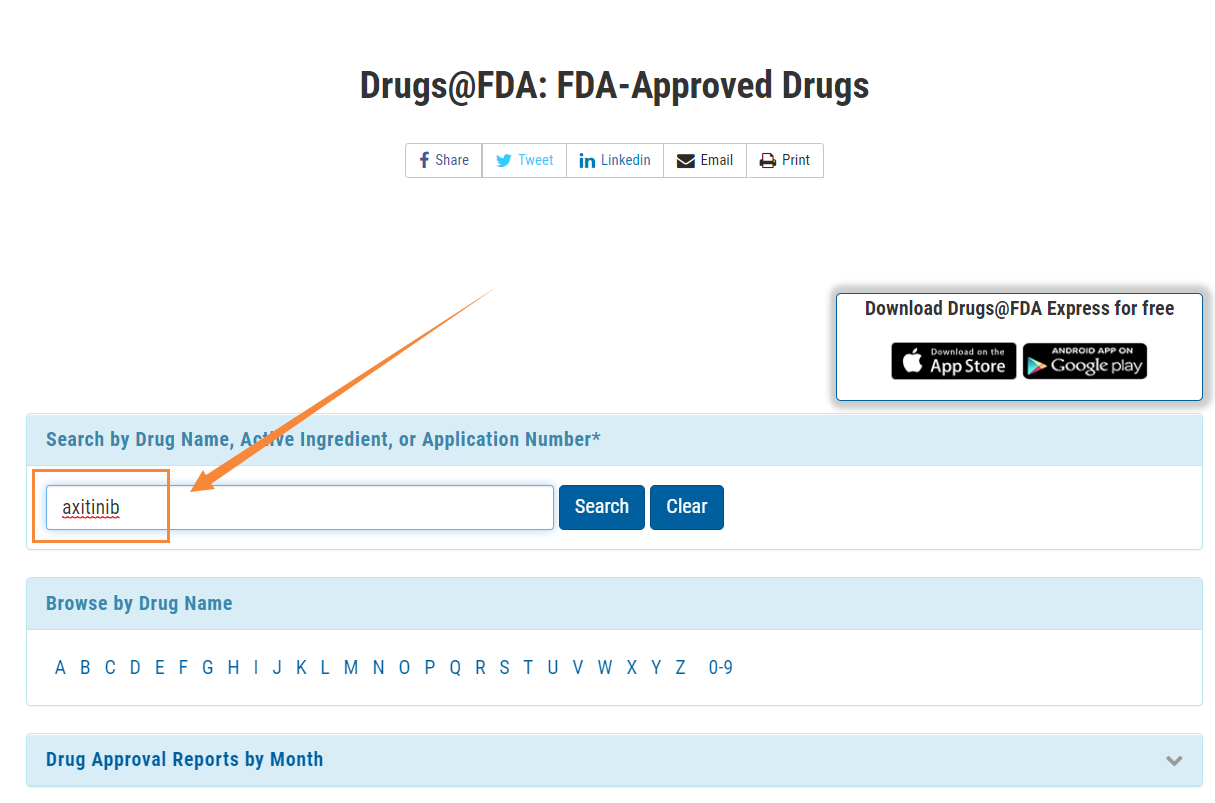
- 進入”Drug Details”,看到藥品詳細信息,點擊”Approval Date(s) and History, Letters, Labels, Reviews for NDA 202324”,在菜單欄目選擇“Review”,即可看到相應的審評報告
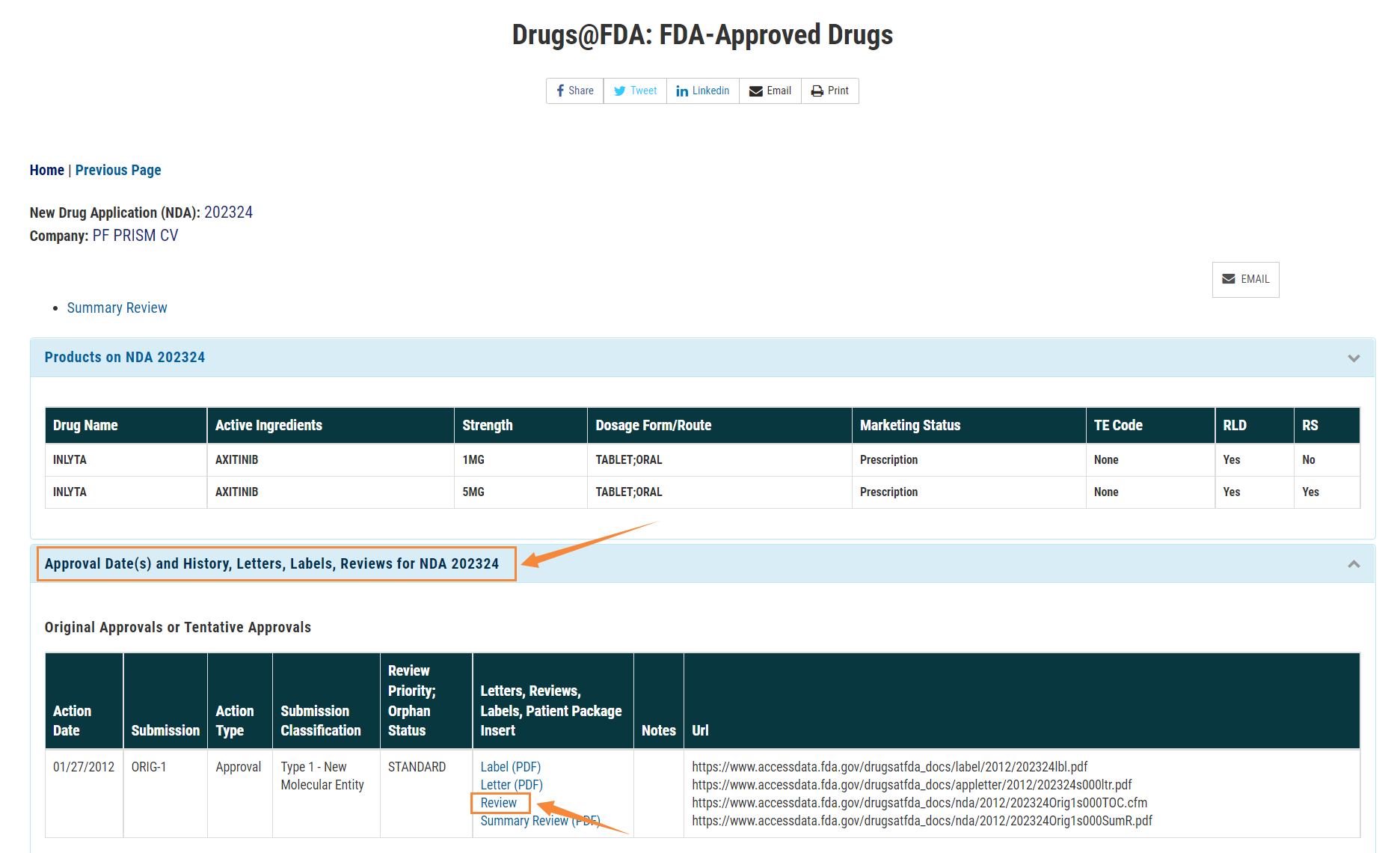
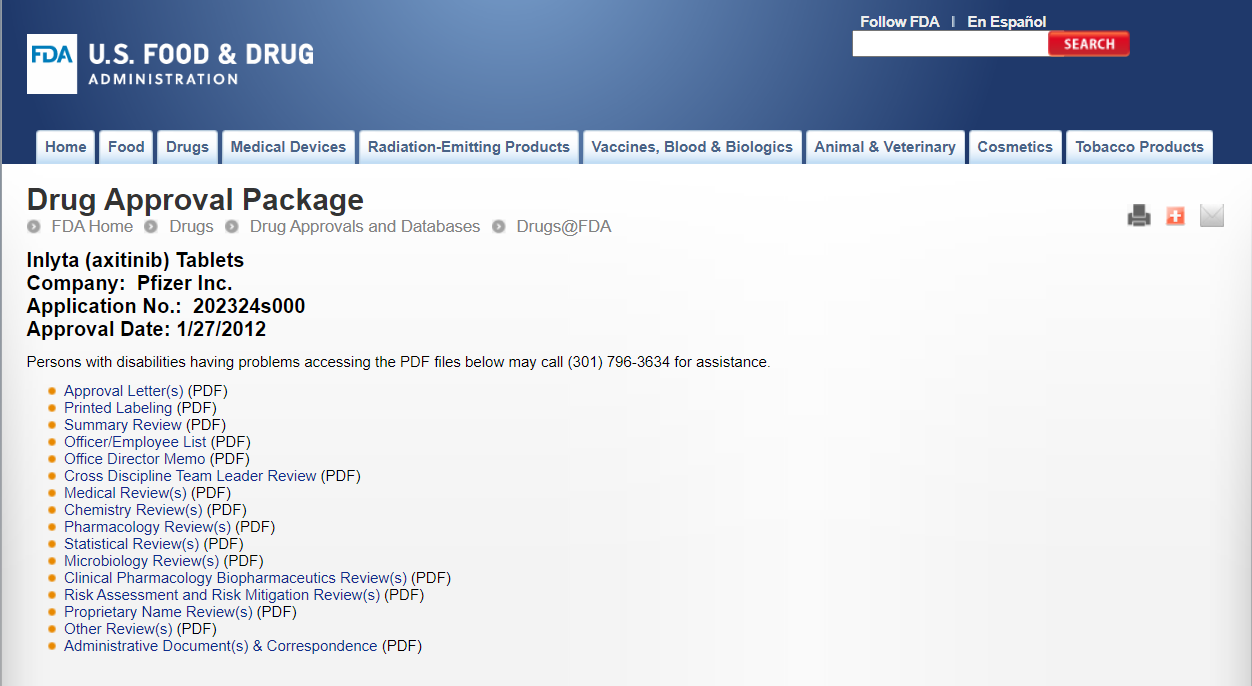
輝瑞公司研發的阿昔替尼片審評報告
FDA審評報告中一般包含研究內容的報告如下:化學審查報告、藥理學審查報告、臨床藥理學/生物藥劑學審查報告、醫學審查報告等。
化學審查報告是對該藥物原料藥與制劑合成/生產工藝、理化性質研究、質量控制體系研究、穩定性研究等方面的審查結論。在阿昔替尼片劑的化學審評報告(Chemistry Review)中,審評員總結概括的內容涉及以下方面:

該部分研究內容將貫穿新藥研發的整個過程,從化合物的發現、篩選、動物實驗,合成路線優化及制劑初步開發,臨床前的制劑優化,以及臨床后可能進行的進一步制劑優化等。
申請人需在新藥上市申請前提交完整的原料藥及制劑研究資料,需要詳細闡述其原料藥合成路線及其合理性、制劑制備工藝及其合理性、各項質量控制方式及其合理性、穩定性研究詳細數據及結論等。
通過原研藥品的Chemistry Review,我們可以直接獲取參比制劑的處方組成及制備工藝,為我們仿制藥的開發節約時間、提高效率。不過,很多時候,由于涉及信息保密,原研化學審評報告中的很多關鍵信息會被打上陰影。
藥理學審評報告含以下內容:


該部分詳細記載了新藥臨床研究審批(IND)申請前藥物在動物體內進行的、能夠證明擬申報藥物在體內安全有效的詳細試驗數據及結論,包括藥理學研究、藥代動力學研究、安全藥理學研究、毒理學研究、藥效學研究等。該部分內容對仿制藥開發可參考意義不大,不過了解一下該藥物的作用機制及不良反應,或許可以更清楚參比制劑劑型、劑量、服用方式、處方工藝等設計的理由。
完成動物水平的安全有效性評價后,需要向FDA提交IND申請,方可開展臨床試驗,臨床藥理學審查報告就是對藥物臨床試驗(包括I期、II期、Ⅲ期)的審查結論。
在阿昔替尼片劑的臨床藥理學/生物藥劑學審評報告中,研究人員/審評員羅列出該藥物在臨床階段所進行的各項臨床研究的名稱和概要。(至少包含16項1期臨床、4項2期臨床、1項3期臨床研究)
以“問題+回答”的方式,對該部分需要關注的重點內容進行了概括,包括:

對于仿制藥開發,臨床藥理學/生物藥劑學審評報告也是我們不可忽略的參考資料。仿制藥上市需要與參比制劑實現體內生物等效,而該文件中所包含的原研不同劑量、空腹/餐后、不同劑型等的藥代動力學數據將有助判斷該藥物體內生物等效的風險,指導制劑開發及BE試驗方案設計。
阿昔替尼片劑的醫學審評報告中,詳細列出了3期臨床試驗的方案設計、合格標準、入組人員信息、療效性數據及分析(無進展生存期分析、中位生存期分析、總生存期分析、客觀緩解率、緩解持續時間)、安全性數據及分析(暴露量、死亡率、由于不良事件而停藥事件、顯著的不良事件、安全性總結)及其他臨床試驗期間對人體各項機能的檢測數據等。
醫學審查報告也是對臨床試驗的審查報告,但與臨床藥理學/生物藥劑學審查報告不同的是,醫學審查報告重點關注并詳細分析關鍵性3期臨床所反映出的該藥物療效性和安全性信息。
該部分內容新藥研發時可參考用來了解FDA審評員的關注點、優化自己的方案設計。
結語
FDA新藥審評報告是醫藥研發領域重要的信息來源,新藥研發可以參考相似藥物的審評報告進行實驗設計和數據把控,仿制藥開發則可以利用參比制劑的審評報告獲取關鍵信息來提高仿制藥開發的成功率、節約開發周期。
-END-


轉載聲明:未經本網或本網權利人授權,不得轉載、摘編或利用其他方式使用上述作品。已經本網或本網權利人授權使用作品的,應在授權范圍內使用,并注明“來源:新領先醫藥科技”。

 Hotline服務熱線:010-61006450
Hotline服務熱線:010-61006450
 簡體中文
簡體中文

 010-61006450
010-61006450 聯系地址:
聯系地址: 技術市場部:
技術市場部: 北京新領先
北京新領先 新領先藥訊
新領先藥訊 010-61006450
010-61006450
