政策法規(guī) || 仿制藥參比制劑目錄(第八十三批)(附法規(guī)概覽10.08-10.12)
01
國(guó)家藥監(jiān)局關(guān)于發(fā)布仿制藥參比制劑目錄(第八十三批)的通告(2024年第37號(hào))
經(jīng)國(guó)家藥品監(jiān)督管理局仿制藥質(zhì)量和療效一致性評(píng)價(jià)專家委員會(huì)審核確定,發(fā)布仿制藥參比制劑目錄(第八十三批)。

掃描圖中二維碼
查看詳細(xì)信息

02
國(guó)家藥監(jiān)局關(guān)于發(fā)布境內(nèi)生產(chǎn)藥品再注冊(cè)申報(bào)程序和申報(bào)資料要求的通告(2024年第38號(hào))
為加強(qiáng)藥品再注冊(cè)管理,根據(jù)《藥品管理法》《疫苗管理法》《藥品管理法實(shí)施條例》《藥品注冊(cè)管理辦法》等法律法規(guī)規(guī)章文件,國(guó)家藥監(jiān)局制定了境內(nèi)生產(chǎn)藥品再注冊(cè)申報(bào)程序和申報(bào)資料要求,自2025年1月1日起施行。

掃描圖中二維碼
查看詳細(xì)信息

03
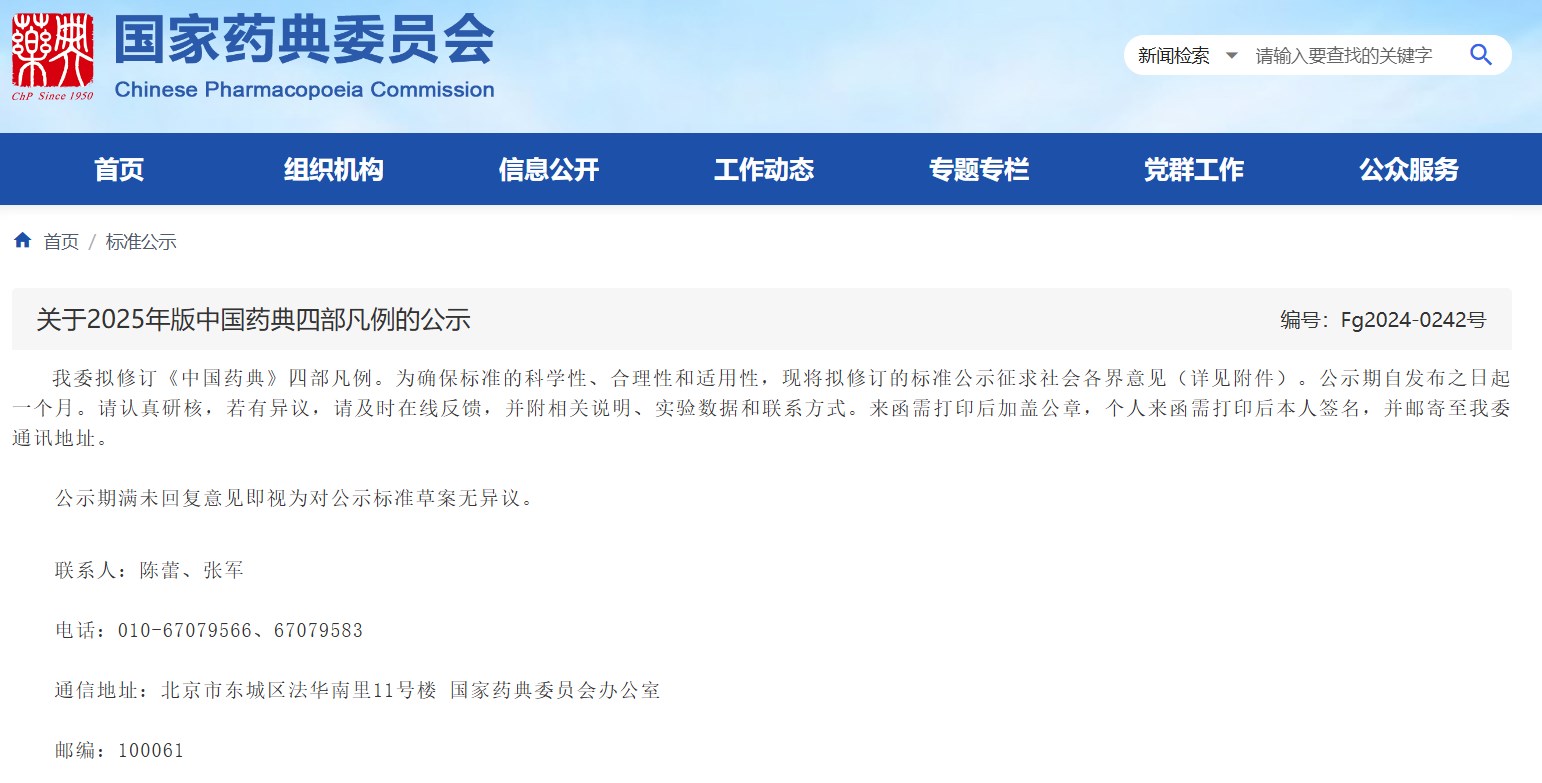
關(guān)于2025年版中國(guó)藥典四部凡例的公示
國(guó)家藥典委擬修訂《中國(guó)藥典》四部凡例。為確保標(biāo)準(zhǔn)的科學(xué)性、合理性和適用性,現(xiàn)將擬修訂的標(biāo)準(zhǔn)公示征求社會(huì)各界意見(jiàn)。
掃描圖中二維碼
查看詳細(xì)信息

NMPA
01
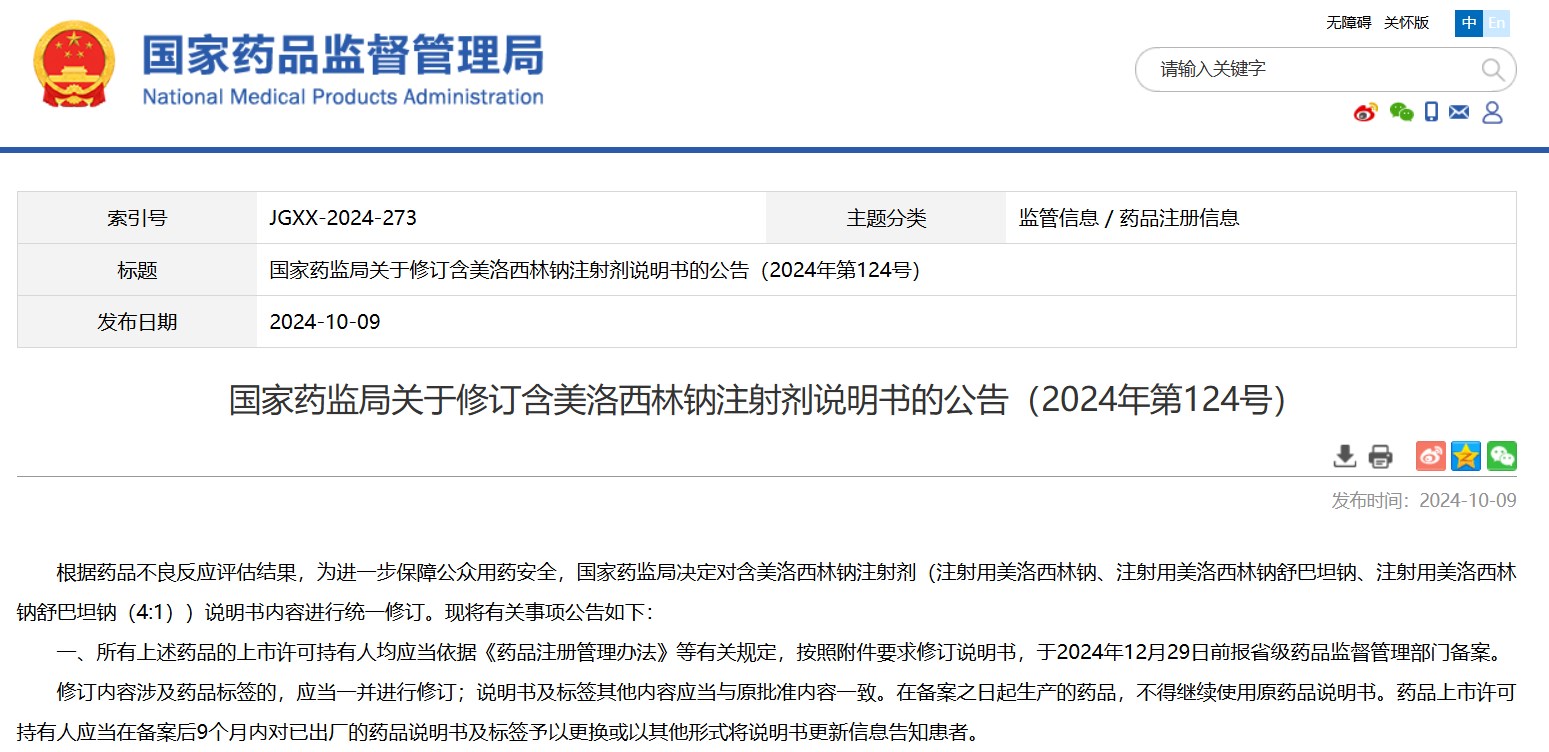
國(guó)家藥監(jiān)局關(guān)于修訂含美洛西林鈉注射劑說(shuō)明書(shū)的公告(2024年第124號(hào))
掃描圖中二維碼
查看詳細(xì)信息

02
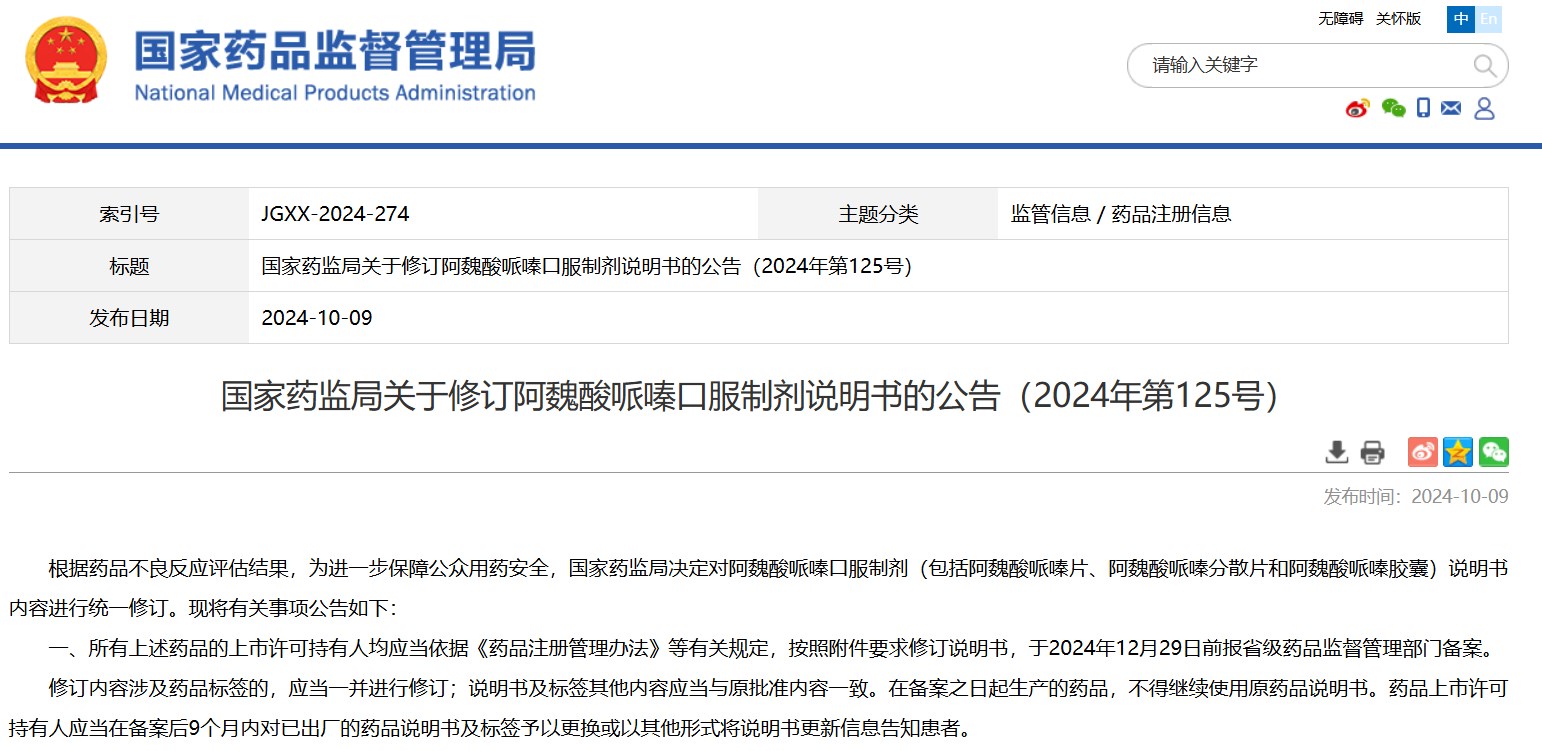
國(guó)家藥監(jiān)局關(guān)于修訂阿魏酸哌嗪口服制劑說(shuō)明書(shū)的公告(2024年第125號(hào))
掃描圖中二維碼
查看詳細(xì)信息

03
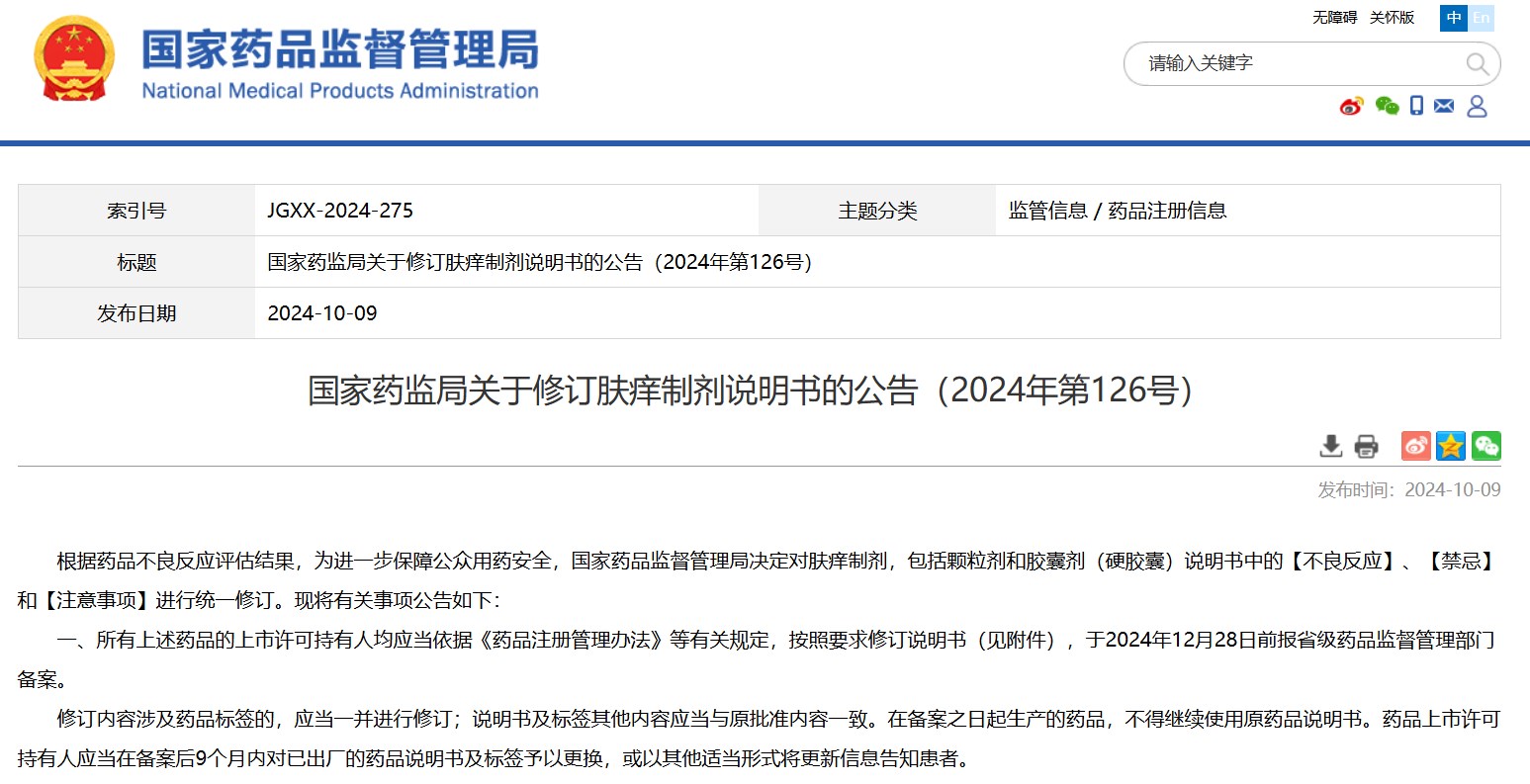
國(guó)家藥監(jiān)局關(guān)于修訂膚癢制劑說(shuō)明書(shū)的公告(2024年第126號(hào))
掃描圖中二維碼
查看詳細(xì)信息

04
2024年10月10日中藥品種保護(hù)受理公示

掃描圖中二維碼
查看詳細(xì)信息

05
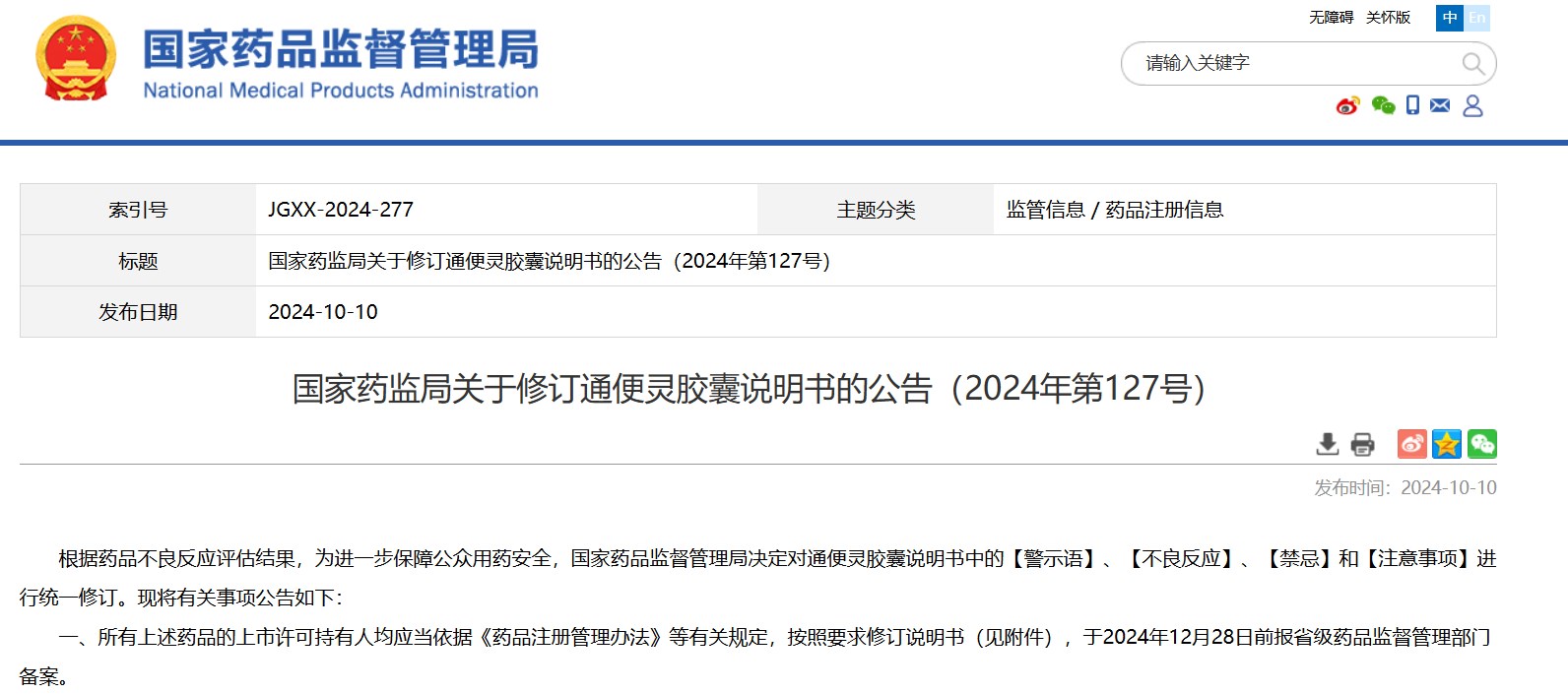
國(guó)家藥監(jiān)局關(guān)于修訂通便靈膠囊說(shuō)明書(shū)的公告(2024年第127號(hào))
掃描圖中二維碼
查看詳細(xì)信息

06
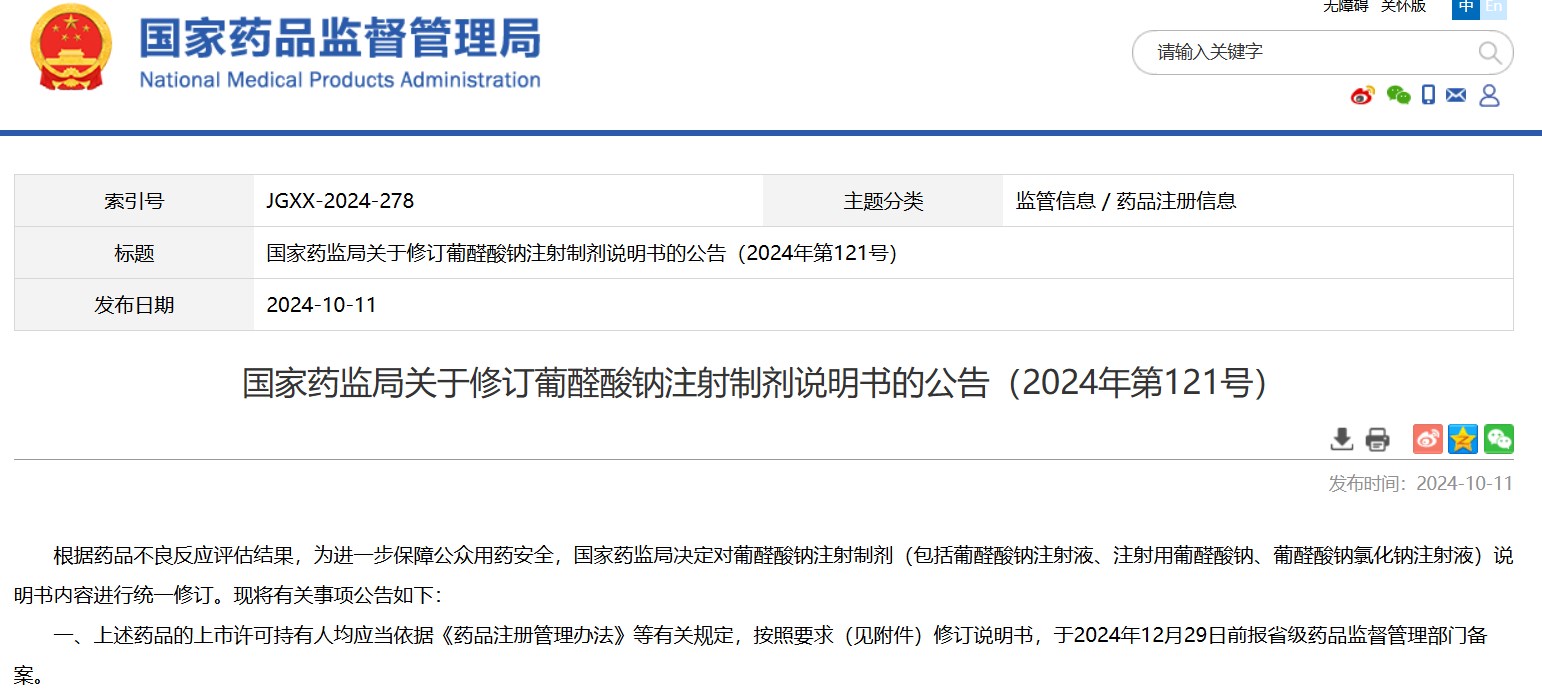
國(guó)家藥監(jiān)局關(guān)于修訂葡醛酸鈉注射制劑說(shuō)明書(shū)的公告(2024年第121號(hào))
掃描圖中二維碼
查看詳細(xì)信息

CDE
01
國(guó)家藥監(jiān)局藥審中心關(guān)于發(fā)布《抗腫瘤藥物臨床試驗(yàn)中SUSAR分析與處理技術(shù)指導(dǎo)原則》的通告(2024年第42號(hào))

掃描圖中二維碼
查看詳細(xì)信息

02
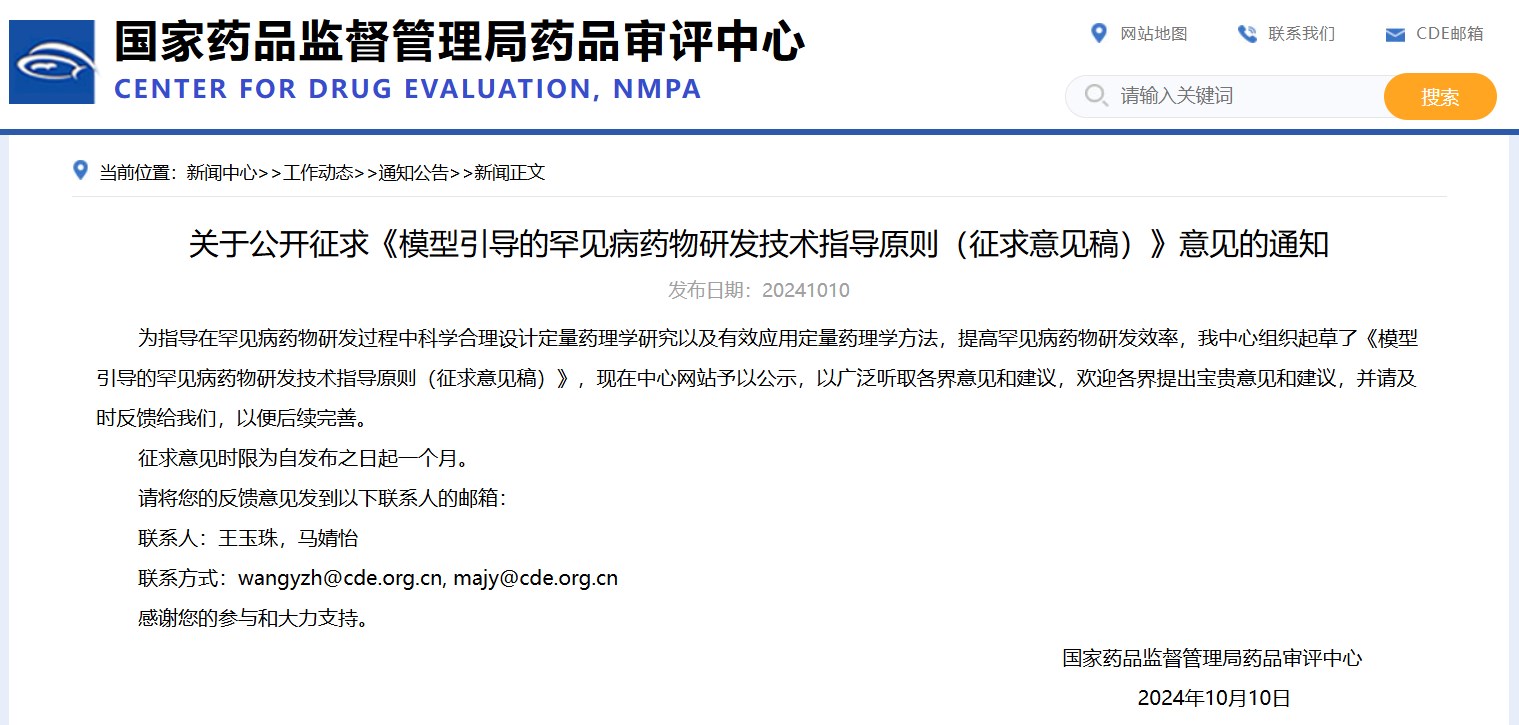
關(guān)于公開(kāi)征求《模型引導(dǎo)的罕見(jiàn)病藥物研發(fā)技術(shù)指導(dǎo)原則(征求意見(jiàn)稿)》意見(jiàn)的通知
掃描圖中二維碼
查看詳細(xì)信息

ADR
01
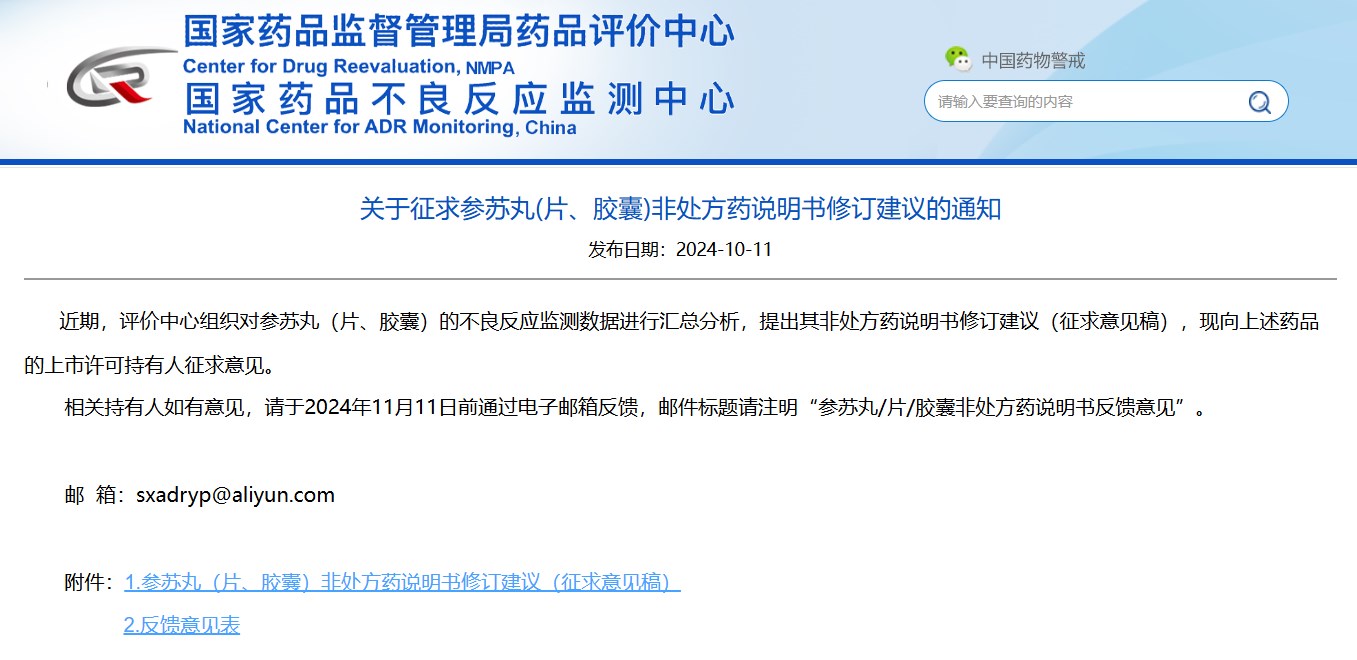
關(guān)于征求參蘇丸(片、膠囊)非處方藥說(shuō)明書(shū)修訂建議的通知
掃描圖中二維碼
查看詳細(xì)信息

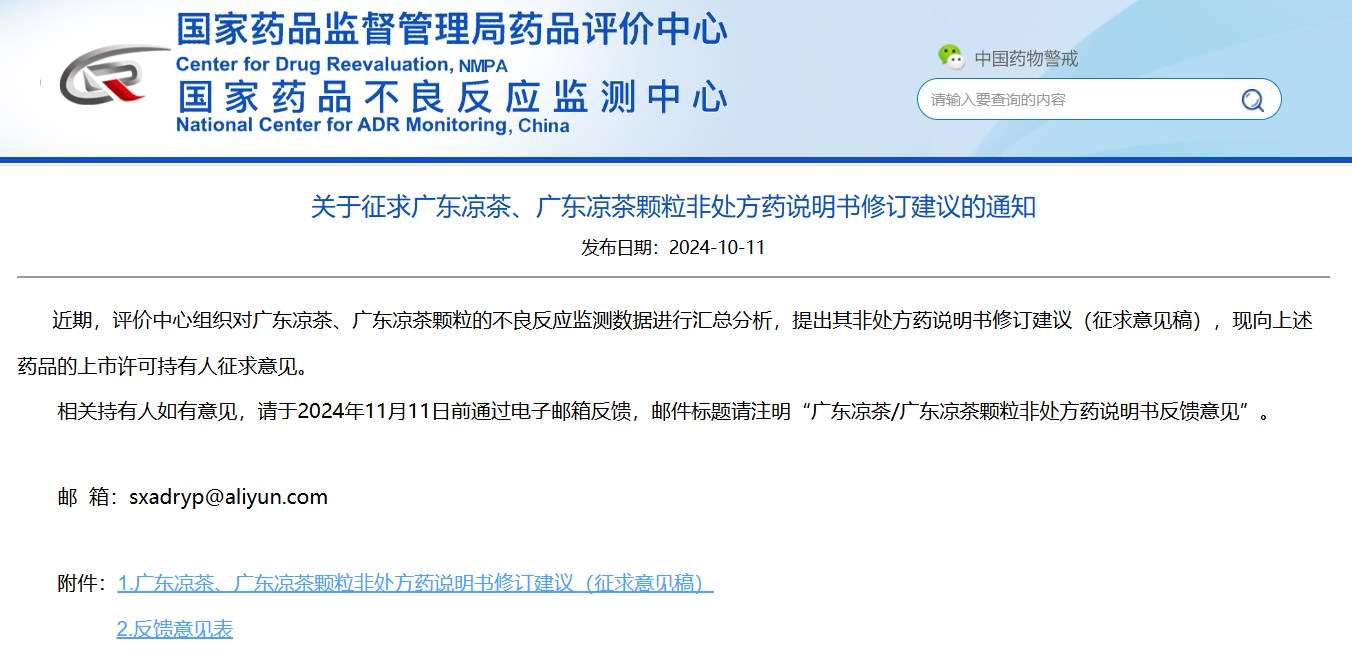
02
關(guān)于征求廣東涼茶、廣東涼茶顆粒非處方藥說(shuō)明書(shū)修訂建議的通知
掃描圖中二維碼
查看詳細(xì)信息

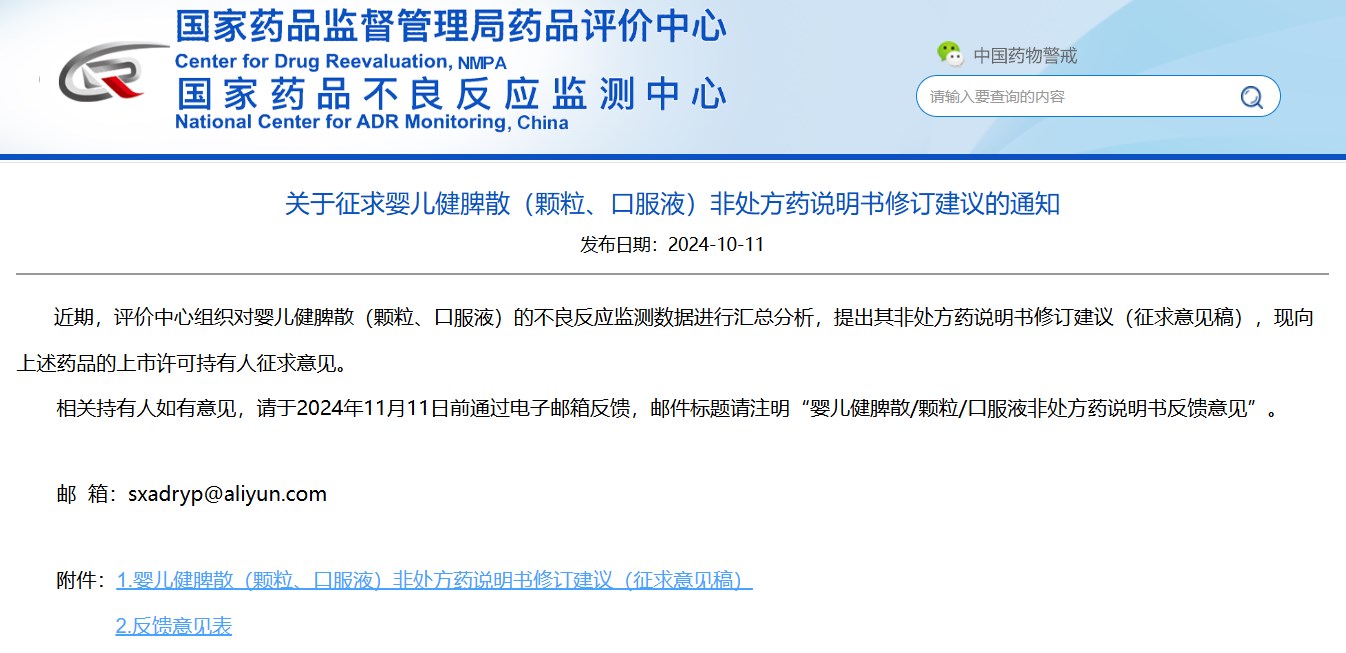
03
關(guān)于征求嬰兒健脾散(顆粒、口服液)非處方藥說(shuō)明書(shū)修訂建議的通知
掃描圖中二維碼
查看詳細(xì)信息

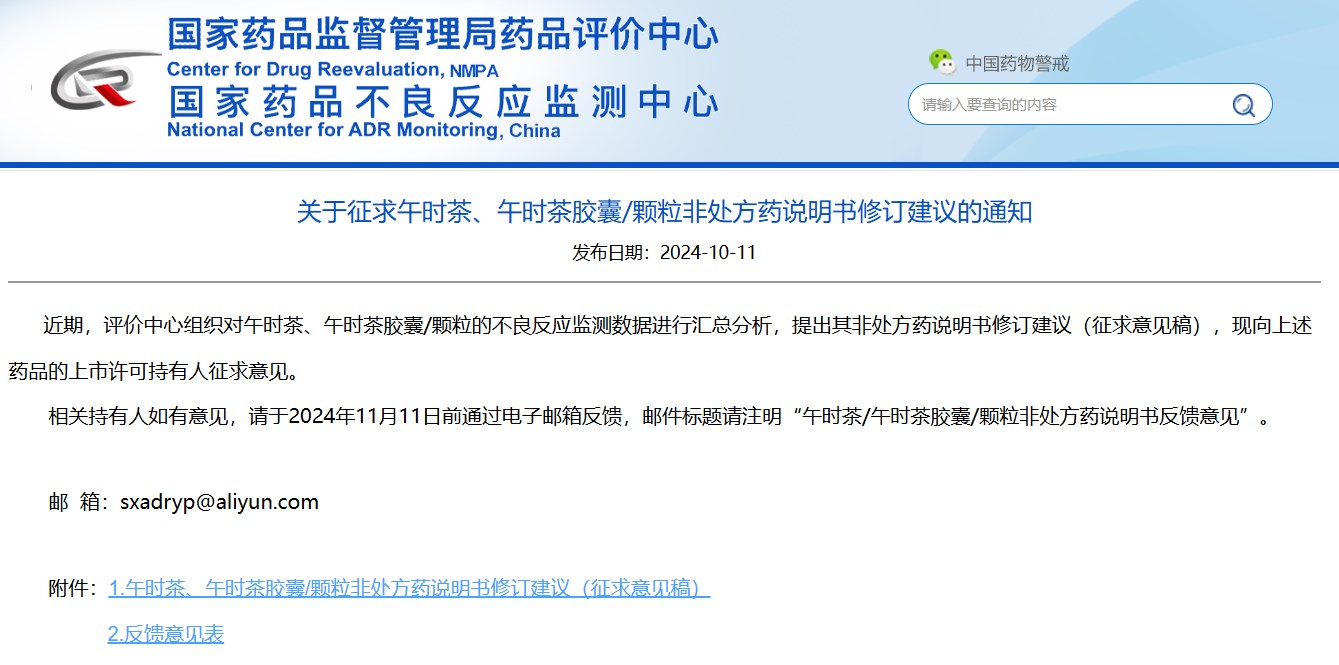
04
關(guān)于征求午時(shí)茶、午時(shí)茶膠囊/顆粒非處方藥說(shuō)明書(shū)修訂建議的通知
掃描圖中二維碼
查看詳細(xì)信息

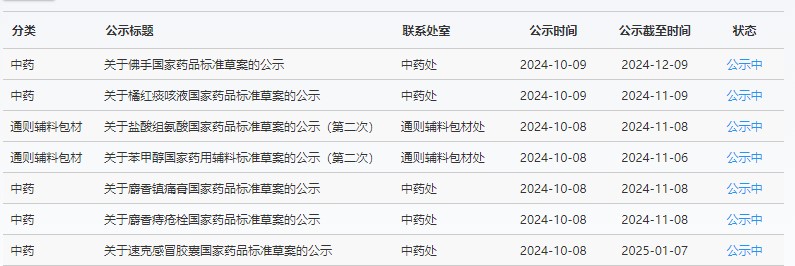
藥典委
近期,藥典委發(fā)布的標(biāo)準(zhǔn)草案公示如下:
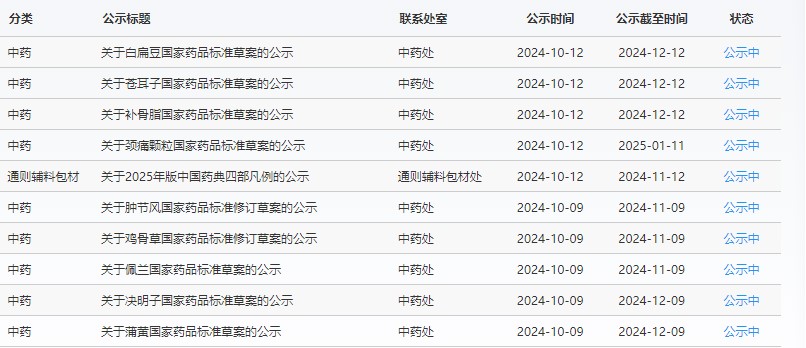
-END-


轉(zhuǎn)載聲明:未經(jīng)本網(wǎng)或本網(wǎng)權(quán)利人授權(quán),不得轉(zhuǎn)載、摘編或利用其他方式使用上述作品。已經(jīng)本網(wǎng)或本網(wǎng)權(quán)利人授權(quán)使用作品的,應(yīng)在授權(quán)范圍內(nèi)使用,并注明“來(lái)源:新領(lǐng)先醫(yī)藥科技”。

 Hotline服務(wù)熱線:010-61006450
Hotline服務(wù)熱線:010-61006450
 簡(jiǎn)體中文
簡(jiǎn)體中文

 010-61006450
010-61006450 聯(lián)系地址:
聯(lián)系地址: 技術(shù)市場(chǎng)部:
技術(shù)市場(chǎng)部: 北京新領(lǐng)先
北京新領(lǐng)先 新領(lǐng)先藥訊
新領(lǐng)先藥訊 010-61006450
010-61006450
